- Понятие электролиза
- Электролиз расплавов
- Электролиз растворов
- Применение электролиза
- иметь представление о процессе электролиза
- уметь составлять окислительно-восстановительные процессы для электролиза расплавов солей
- уметь составлять окислительно-восстановительные процессы для электролиза растворов солей
Вы уже знаете, что такое окислительно-восстановительные реакции. Они основаны на принятии и отдаче электронов. Существует схожий процесс. Так, в растворах и расплавах электролитов происходит направленное движение электронов, определяющее их заряд. Явление носит название электролиза. В данном процессе определяются ионы, которые несут положительный заряд, при этом они направляются к отрицательно заряженному катоду, в связи с этим они носят название катионы. Также существуют противоположные частицы, которые несут отрицательный заряд и направленно движутся к положительному аниону, что образует их название анионы.
В результате движения ионы достигают поверхности электрода и соприкасаются с ним. Происходит разряд иона, и он приобретает заряд, свойственный электроду.
Таким образом, ярко видны основные отличия электролиза от ОВР. В первом случае в качестве окислителя и восстановителя является электрический ток, а во втором — окислителем и восстановителем выступают сами вещества. Также необходимо отметить, что процессы окисления и восстановления не протекают одновременно и происходят в результате взаимодействия не частиц между собой, а путём соприкосновения с электродами электрической цепи.
Понятие электролиза
В зависимости от участвующих в реакции веществ процесс подразделяется на два вида: электролиз расплавов и растворов.
Электролиз представляет собой совокупность окислительно-восстановительных реакций, которые протекают под действием постоянного электрического тока на электродах, погружённых в раствор или расплав электролита.
При электролизе процессы окисления и восстановления протекают на различных электродах — аноде и катоде.
Анод — это электрод, на котором происходит процесс окисления, при этом он заряжен положительно.
Катод — это электрод, на котором происходит процесс восстановления, при этом он заряжен отрицательно.
Следует отметить, что на окислительно-восстановительные процессы, протекающие при электролизе, влияют различные факторы:
- природа электролита и растворителя;
- материал электродов;
- режим электролиза (напряжение, сила тока, температура).
Электролиз расплавов
При расплаве твёрдых ионных соединений идёт процесс электролитической диссоциации. В начале истории открытия электролиза учёным удалось получить расплав поваренной соли и разложить на металлический натрий и зелёный ядовитый газ хлор на аноде.
В настоящее время в промышленных масштабах электролизом расплава соли получают галогены, водород, кислород, а также активные металлы: щелочные, щёлочноземельные и алюминий.
Первооткрывателем электролиза является Дэвид Гемфри. Уже в 1799 году он провёл эксперимент по разложению воды электрическим током. В результате эксперимента он доказал, что вода состоит из водорода и кислорода. Одновременно с этим было открыто явление электролиза.
В 1886 году Чарлз Холл открыл способ получения алюминия электролизом расплава глинозёмно-криолитной смеси. В настоящее время алюминий получают расплавом бокситов или глинозёма.
В 1906 году французский химик Анри Муассан получил медаль Нобелевского лауреата за открытие фтора, который выделил из фторида калия.
При электролизе расправленное соединение распадается на ионы. Например, при электролизе хлорида меди (II) вещество распадается на ионы:
.
Пример 1
Написать электролиз расплава хлорида железа (II).
Решение
Давайте выясним, как идёт процесс электролиза расплава.
1. В расплаве хлорид железа (II) диссоциирует, образуя катионы железа и анионы хлора: .
2. На катоде всегда происходит процесс восстановления, а на аноде — процесс окисления. Поэтому при электролизе расплава хлорида железа на катоде происходит процесс восстановления катионов железа, а на аноде — процесс окисления анионов хлора, значит, атомы приобретают нулевую степень окисления.
3. Катодная реакция : .
4. Анодная реакция : .
5. Запишем суммарный процесс: .
6. Объединяем первую и последнюю реакции и получаем расплав
.
Упражнение 1
Запишите электролиз бромида натрия. Какой процесс протекает на аноде?
Электролиз растворов
Процесс электролиза расплавов протекает при участии молекул воды, которые не всегда остаются безразличными к воздействию электрического разряда на электродах. Процессы электролиза для различных типов солей на катоде и аноде протекают неодинаково. Рассмотрим эти процессы. В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электрохимический ряд напряжений.

Каждый металл характеризуется значением электрохимического потенциала. Чем меньше потенциал, тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла.
Разным ионам соответствуют разные значения этого потенциала.
Электрохимический потенциал — относительная величина.
Электрохимический потенциал водорода принят равным нулю. Также около катода находятся молекулы воды . Это связано с тем, что составе воды есть окислитель — ион .
При электролизе растворов солей на катоде наблюдаются следующие закономерности.
Если металл в соли — активный (до включительно в ряду напряжений), то вместо металла на катоде восстанавливается водород, потому что потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы , а среда возле катода — щелочная.
Пример 2
Написать электролиз раствора хлорида бария.
Решение
Давайте рассмотрим, как идёт процесс электролиза раствора активного металла.
1. В растворе хлорид бария диссоциирует, образуя катионы бария и анионы хлора: .
2. Барий — активный металл и происходит процесс восстановления водорода. На аноде идет процесс окисления хлора.
3. Катодная реакция .
4. Анодная реакция .
5. Запишем суммарный процесс: .
6. Объединяем первую и последнюю реакции и получаем раствор, где ионы бария соединяются со свободными анионами:
.
Если металл в соли средней активности (между Al и Н2), то на катоде восстанавливается и металл, и водород, так как потенциал таких металлов сравним с потенциалом водорода:
,
.
Пример 3
Написать электролиз раствора сульфата железа.
Решение
Давайте рассмотрим, как идёт процесс электролиза раствора металла.
1. В растворе сульфат железа (II) диссоциирует, образуя катионы железа и сульфат-анионы:
2. Железо — металл средней активности, поэтому на катоде происходит процесс восстановления металла и водорода.
3. Катодная реакция ,
.
4. Фторид-анионы и анионы кислородсодержащих кислот при электролизе водных растворов (солей, кислот) на аноде не окисляются. Поэтому происходит процесс окисления воды.
5. Анодная реакция .
6. Запишем суммарный процесс:
.
7. Сокращаем, объединяя ионы водорода и гидроксид-ионы:
.
8. Объединяем первую и последнюю реакции и получаем раствор, где ионы водорода соединяются со свободными сульфат-анионами:
.
Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов), то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
.
Пример 4
Написать электролиз раствора нитрата серебра.
Решение
Давайте рассмотрим, как идёт процесс электролиза раствора металла.
1. В растворе нитрат серебра диссоциирует, образуя катионы серебра и нитрат-анионы:
2. Серебро — неактивный металл, поэтому на катоде происходит процесс восстановления металла.
3. Катодная реакция .
4. Фторид-анионы и анионы кислородсодержащих кислот при электролизе водных растворов (солей, кислот) на аноде не окисляются. Поэтому происходит процесс окисления воды.
5. Анодная реакция .
6. Запишем суммарный процесс:
.
7. Объединяем первую и последнюю реакции и получаем раствор, где ионы водорода соединяются со свободными нитрат-анионами:
.
8. Уравниваем получившуюся реакцию:
.
При записи процессов электролиза следует помнить, что соли, образованные катионом сильного основания и сильной кислоты (катионы щелочного металла и анионы кислородсодержащей кислоты), не окисляются и не восстанавливаются. В окислительно-восстановительных реакциях на электродах участвует только вода.
Упражнение 2
1. Выберите, в каком случае, при электролизе раствора, на катоде будет восстанавливаться только металл: . Почему?
2. Записать уравнение электролиза хлорида цинка. Какая реакция на катоде? Почему?
Применение электролиза
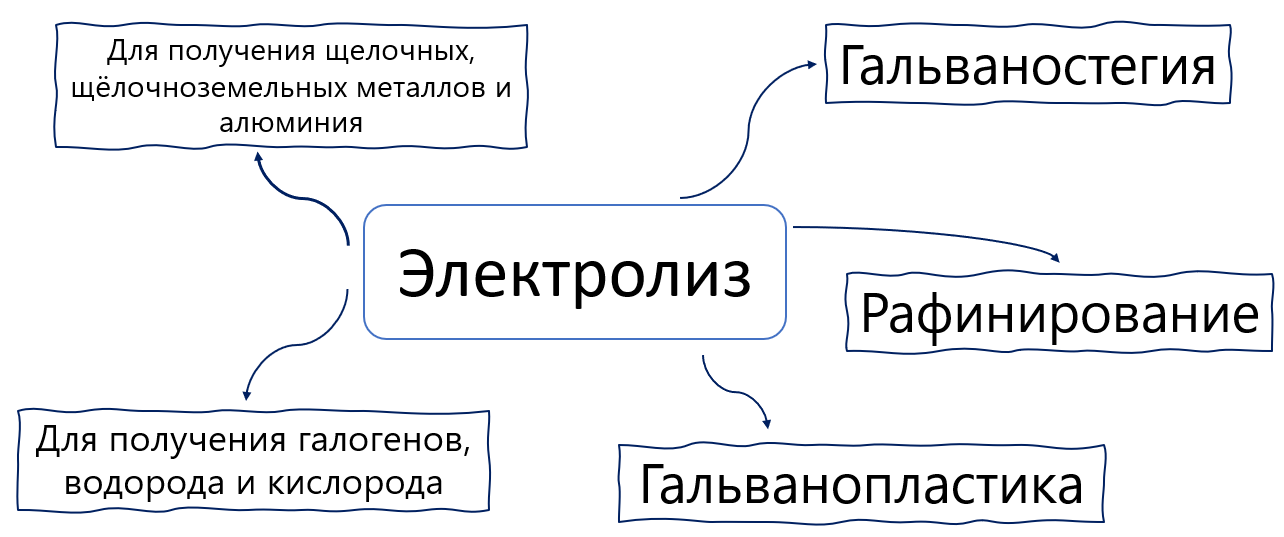
На схеме представлены области применения электролиза. Так, электролиз широко применяется в промышленности для выделения чистых металлов, а также для нанесения металлических покрытий на поверхность изделий (никелирование, хромирование, золочение), а также для очистки металлов от примесей.
Контрольные вопросы
1. Что заключается в понятии «электролиз»?
2. В чём отличие электролиза от окислительно-восстановительных реакций?
3. В процессе электролиза растворов сильных электролитов почему не происходит их окисления/восстановления на электродах?
Ответы
Упражнение 1
На аноде восстанавливается бром: .
Упражнение 2
1. — восстанавливается медь, т. к. слабый металл.
2. Реакция на катоде — восстановление металла и водорода, т. к. металл средней активности:
- Понятие электролиза
- Электролиз расплавов
- Электролиз растворов
- Применение электролиза
- иметь представление о процессе электролиза
- уметь составлять окислительно-восстановительные процессы для электролиза расплавов солей
- уметь составлять окислительно-восстановительные процессы для электролиза растворов солей
Вы уже знаете, что такое окислительно-восстановительные реакции. Они основаны на принятии и отдаче электронов. Существует схожий процесс. Так, в растворах и расплавах электролитов происходит направленное движение электронов, определяющее их заряд. Явление носит название электролиза. В данном процессе определяются ионы, которые несут положительный заряд, при этом они направляются к отрицательно заряженному катоду, в связи с этим они носят название катионы. Также существуют противоположные частицы, которые несут отрицательный заряд и направленно движутся к положительному аниону, что образует их название анионы.
В результате движения ионы достигают поверхности электрода и соприкасаются с ним. Происходит разряд иона, и он приобретает заряд, свойственный электроду.
Таким образом, ярко видны основные отличия электролиза от ОВР. В первом случае в качестве окислителя и восстановителя является электрический ток, а во втором — окислителем и восстановителем выступают сами вещества. Также необходимо отметить, что процессы окисления и восстановления не протекают одновременно и происходят в результате взаимодействия не частиц между собой, а путём соприкосновения с электродами электрической цепи.
Понятие электролиза
В зависимости от участвующих в реакции веществ процесс подразделяется на два вида: электролиз расплавов и растворов.
Электролиз представляет собой совокупность окислительно-восстановительных реакций, которые протекают под действием постоянного электрического тока на электродах, погружённых в раствор или расплав электролита.
При электролизе процессы окисления и восстановления протекают на различных электродах — аноде и катоде.
Анод — это электрод, на котором происходит процесс окисления, при этом он заряжен положительно.
Катод — это электрод, на котором происходит процесс восстановления, при этом он заряжен отрицательно.
Следует отметить, что на окислительно-восстановительные процессы, протекающие при электролизе, влияют различные факторы:
- природа электролита и растворителя;
- материал электродов;
- режим электролиза (напряжение, сила тока, температура).
Электролиз расплавов
При расплаве твёрдых ионных соединений идёт процесс электролитической диссоциации. В начале истории открытия электролиза учёным удалось получить расплав поваренной соли и разложить на металлический натрий и зелёный ядовитый газ хлор на аноде.
В настоящее время в промышленных масштабах электролизом расплава соли получают галогены, водород, кислород, а также активные металлы: щелочные, щёлочноземельные и алюминий.
Первооткрывателем электролиза является Дэвид Гемфри. Уже в 1799 году он провёл эксперимент по разложению воды электрическим током. В результате эксперимента он доказал, что вода состоит из водорода и кислорода. Одновременно с этим было открыто явление электролиза.
В 1886 году Чарлз Холл открыл способ получения алюминия электролизом расплава глинозёмно-криолитной смеси. В настоящее время алюминий получают расплавом бокситов или глинозёма.
В 1906 году французский химик Анри Муассан получил медаль Нобелевского лауреата за открытие фтора, который выделил из фторида калия.
При электролизе расправленное соединение распадается на ионы. Например, при электролизе хлорида меди (II) вещество распадается на ионы:
.
Пример 1
Написать электролиз расплава хлорида железа (II).
Решение
Давайте выясним, как идёт процесс электролиза расплава.
1. В расплаве хлорид железа (II) диссоциирует, образуя катионы железа и анионы хлора: .
2. На катоде всегда происходит процесс восстановления, а на аноде — процесс окисления. Поэтому при электролизе расплава хлорида железа на катоде происходит процесс восстановления катионов железа, а на аноде — процесс окисления анионов хлора, значит, атомы приобретают нулевую степень окисления.
3. Катодная реакция : .
4. Анодная реакция : .
5. Запишем суммарный процесс: .
6. Объединяем первую и последнюю реакции и получаем расплав
.
Упражнение 1
Запишите электролиз бромида натрия. Какой процесс протекает на аноде?
Электролиз растворов
Процесс электролиза расплавов протекает при участии молекул воды, которые не всегда остаются безразличными к воздействию электрического разряда на электродах. Процессы электролиза для различных типов солей на катоде и аноде протекают неодинаково. Рассмотрим эти процессы. В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электрохимический ряд напряжений.

Каждый металл характеризуется значением электрохимического потенциала. Чем меньше потенциал, тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла.
Разным ионам соответствуют разные значения этого потенциала.
Электрохимический потенциал — относительная величина.
Электрохимический потенциал водорода принят равным нулю. Также около катода находятся молекулы воды . Это связано с тем, что составе воды есть окислитель — ион .
При электролизе растворов солей на катоде наблюдаются следующие закономерности.
Если металл в соли — активный (до включительно в ряду напряжений), то вместо металла на катоде восстанавливается водород, потому что потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы , а среда возле катода — щелочная.
Пример 2
Написать электролиз раствора хлорида бария.
Решение
Давайте рассмотрим, как идёт процесс электролиза раствора активного металла.
1. В растворе хлорид бария диссоциирует, образуя катионы бария и анионы хлора: .
2. Барий — активный металл и происходит процесс восстановления водорода. На аноде идет процесс окисления хлора.
3. Катодная реакция .
4. Анодная реакция .
5. Запишем суммарный процесс: .
6. Объединяем первую и последнюю реакции и получаем раствор, где ионы бария соединяются со свободными анионами:
.
Если металл в соли средней активности (между Al и Н2), то на катоде восстанавливается и металл, и водород, так как потенциал таких металлов сравним с потенциалом водорода:
,
.
Пример 3
Написать электролиз раствора сульфата железа.
Решение
Давайте рассмотрим, как идёт процесс электролиза раствора металла.
1. В растворе сульфат железа (II) диссоциирует, образуя катионы железа и сульфат-анионы:
2. Железо — металл средней активности, поэтому на катоде происходит процесс восстановления металла и водорода.
3. Катодная реакция ,
.
4. Фторид-анионы и анионы кислородсодержащих кислот при электролизе водных растворов (солей, кислот) на аноде не окисляются. Поэтому происходит процесс окисления воды.
5. Анодная реакция .
6. Запишем суммарный процесс:
.
7. Сокращаем, объединяя ионы водорода и гидроксид-ионы:
.
8. Объединяем первую и последнюю реакции и получаем раствор, где ионы водорода соединяются со свободными сульфат-анионами:
.
Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов), то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
.
Пример 4
Написать электролиз раствора нитрата серебра.
Решение
Давайте рассмотрим, как идёт процесс электролиза раствора металла.
1. В растворе нитрат серебра диссоциирует, образуя катионы серебра и нитрат-анионы:
2. Серебро — неактивный металл, поэтому на катоде происходит процесс восстановления металла.
3. Катодная реакция .
4. Фторид-анионы и анионы кислородсодержащих кислот при электролизе водных растворов (солей, кислот) на аноде не окисляются. Поэтому происходит процесс окисления воды.
5. Анодная реакция .
6. Запишем суммарный процесс:
.
7. Объединяем первую и последнюю реакции и получаем раствор, где ионы водорода соединяются со свободными нитрат-анионами:
.
8. Уравниваем получившуюся реакцию:
.
При записи процессов электролиза следует помнить, что соли, образованные катионом сильного основания и сильной кислоты (катионы щелочного металла и анионы кислородсодержащей кислоты), не окисляются и не восстанавливаются. В окислительно-восстановительных реакциях на электродах участвует только вода.
Упражнение 2
1. Выберите, в каком случае, при электролизе раствора, на катоде будет восстанавливаться только металл: . Почему?
2. Записать уравнение электролиза хлорида цинка. Какая реакция на катоде? Почему?
Применение электролиза
На схеме представлены области применения электролиза. Так, электролиз широко применяется в промышленности для выделения чистых металлов, а также для нанесения металлических покрытий на поверхность изделий (никелирование, хромирование, золочение), а также для очистки металлов от примесей.

Контрольные вопросы
1. Что заключается в понятии «электролиз»?
2. В чём отличие электролиза от окислительно-восстановительных реакций?
3. В процессе электролиза растворов сильных электролитов почему не происходит их окисления/восстановления на электродах?
Ответы
Упражнение 1
На аноде восстанавливается бром: .
Упражнение 2
1. — восстанавливается медь, т. к. слабый металл.
2. Реакция на катоде — восстановление металла и водорода, т. к. металл средней активности:



