- Удельная теплота парообразования
- Кипение. Температура кипения
- Примеры решения задач
- знать различия между кипением и испарением; определение термина «кипение»; что называют удельной теплотой парообразования; формулу для расчёта количества теплоты, необходимого для превращения жидкости в пар
- уметь объяснять процессы, происходящие внутри жидкости в процессе кипения; находить количество теплоты, необходимое для превращения жидкости в пар; объяснять взаимосвязь между температурой кипения и внешним давлением
- Как зависит давление насыщенного пара от температуры?
- При какой температуре происходит испарение жидкости?
- Может ли вода кипеть при температуре, отличной от 100 °С?
Удельная теплота парообразования
Вам уже известно, что при испарении внутренняя энергия вещества уменьшается, поэтому вещество охлаждается. Однако, если в процессе испарения сообщать жидкости дополнительное тепло, можно поддерживать её температуру неизменной.
Очевидно, что разные жидкости теряют разное количество теплоты при испарении, что связано с различиями во внутреннем строении, поэтому необходимое количество теплоты зависит от рода жидкости.
Удельная теплота парообразования L — это физическая величина, равная количеству теплоты, необходимому для превращения 1 кг жидкости в пар (или пара в жидкость) при постоянной температуре и постоянном внешнем давлении.
В СИ единица измерения удельной теплоты парообразования — джоуль на килограмм (Дж/кг).
В таблице 1 приведены значения удельной теплоты парообразования для некоторых веществ.
Таблица 1. Удельная теплота парообразования некоторых веществ
|
Вещество
|
Удельная теплота парообразования, МДж/кг
|
Вещество
|
Удельная теплота парообразования, МДж/кг
|
|
аммиак
|
1,4
|
эфир
|
0,4
|
|
жидкий воздух
|
0,2
|
ртуть
|
0,3
|
|
спирт
|
0,9
|
вода
|
2,3
|
Из таблицы следует, что для превращения в пар 1 кг эфира необходимо затратить 0,4 МДж. Соответственно, для превращения в пар 2 кг эфира необходимо 0,8 МДж. Ясно, что количество теплоты, необходимое для парообразования жидкости, прямо пропорционально массе этой жидкости. Чем больше масса вещества, тем больше тепловой энергии необходимо затратить — количество теплоты, необходимое для превращения жидкости в пар, прямо пропорционально массе жидкости m:
,
где Q [Дж] — количество теплоты, необходимое для превращения жидкости в пар;
L [Дж/кг] — удельная теплота парообразования;
m [кг] — масса жидкости.
Количество теплоты Q, необходимое для превращения жидкости в пар, находится как произведение удельной теплоты парообразования L на массу этой жидкости m:
.
Конденсация пара всегда сопровождается выделением тепла: термодинамическая система в процессе конденсации нагревается. При этом если для превращения в пар 1 кг спирта требуется 0,9 МДж, то при конденсации того же количества спирта выделится ровно такое количество энергии 0,9 МДж. Поэтому количество теплоты, выделяемое при конденсации жидкости массой m, находится по этой же формуле.
В процессе конденсации выделяется такое же количество теплоты Q, какое было затрачено для превращения данного количества жидкости в пар:
Знак «−» означает, что система выделяет тепло.
Кипение. Температура кипения
Вспомним, что испарение — это переход жидкости в газ, происходящий при любой температуре, при котором молекулы вещества покидают поверхность жидкости или твёрдого тела.
Существует и другой вид перехода из жидкого состояния в газообразное, который происходит внутри объёма жидкости. Данный процесс называется кипением. Кипение, как и конденсация, тоже является видом парообразования, но существуют значительные различия в механизмах протекания данных явлений.
Рассмотрим подробно, что происходит внутри жидкости в процессе кипения.
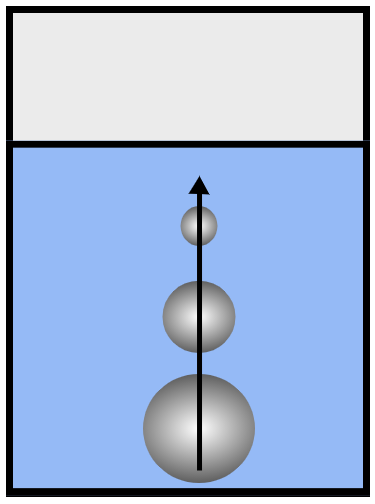 Рис. 1. Поднимающиеся пузырьки лопаются, оказавшись в менее нагретых слоях жидкости
Рис. 1. Поднимающиеся пузырьки лопаются, оказавшись в менее нагретых слоях жидкости
При нагревании жидкости в прозрачном сосуде можно наблюдать образование маленьких пузырьков на дне и стенках сосуда — это пузырьки воздуха, присутствующего в воде. В процессе нагревания вода испаряется внутрь этих пузырьков, поэтому в каждом из них помимо воздуха находится насыщенный пар.
Дальнейшее увеличение температуры ведёт к увеличению давления насыщенного пара внутри пузырьков, в результате чего они начинают увеличиваться в объёме. Увеличение объёма приводит к росту силы Архимеда, действующей на пузырьки, а когда выталкивающая сила достигнет определённого значения, пузырёк сможет оторваться от дна и начать всплывать.
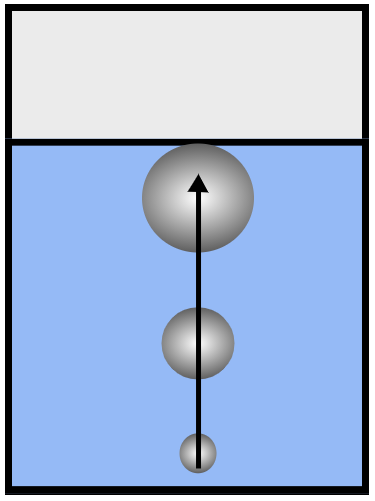 Рис. 2. Когда весь объём воды равномерно прогрет, пузырьки при подъёме увеличиваются в объёме и достигают поверхности — вода кипит
Рис. 2. Когда весь объём воды равномерно прогрет, пузырьки при подъёме увеличиваются в объёме и достигают поверхности — вода кипит
По мере приближения к поверхности жидкости пузырёк проходит через менее нагретые верхние слои воды. Из-за охлаждения насыщенный пар внутри пузырьков конденсируется, пузырьки уменьшаются в объёме и лопаются, не достигнув поверхности (рис. 1).
Когда вода прогреется по всему объёму равномерно, процесс испарения жидкости внутрь пузырьков не будет прекращаться при их подъёме на поверхность. Напротив, всплывая, пузырьки будут увеличиваться в объёме, достигать поверхности воды и лопаться на границе раздела двух сред — вода забурлит — мы наблюдаем процесс кипения (рис. 2). Образование, рост и всплытие пузырьков сопровождаются характерным шумом, по которому можно определить начало и эффективность процесса кипения.
Кипение — это переход жидкости в пар, происходящий с образованием в объёме жидкости пузырьков пара.
Эксперименты показывают, что процесс кипения протекает при определённой температуре — температуре кипения, которая не меняется, пока вся жидкость не перейдёт в парообразное состояние. Отчего же зависит температура кипения?
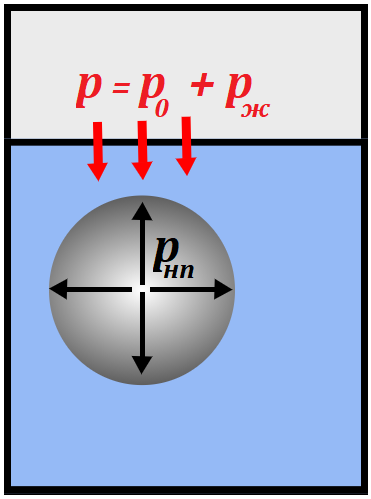 Рис. 3. При кипении давление внутри пузырьков больше или равно внешнему давлению
Рис. 3. При кипении давление внутри пузырьков больше или равно внешнему давлению
Как уже было сказано, в процессе кипения пузырьки внутри жидкости растут в объёме, так как давление насыщенного пара внутри пузырьков увеличивается. Понятно, что снаружи на пузырьки действует давление жидкости и атмосферное давление, увеличение объёма возможно только в том случае, если давление насыщенного пара внутри пузырьков будет больше или равно внешнему давлению (рис. 3).
В противном случае, если внешнее давление будет больше давления насыщенного пара внутри пузырьков, пузырьки будут лопаться, не достигнув поверхности.
Температура, при которой жидкость кипит, называют температурой кипения этой жидкости. В процессе кипения температура жидкости не меняется, а всё подводимое тепло уходит на парообразование.
Например, температура кипения воды при нормальном атмосферном давлении равна 100 °С. Пусть сосуд с водой имеет маленькую глубину, в этом случае гидростатическим давлением можно пренебречь. В процессе кипения давление насыщенного пара pнп внутри пузырьков равно давлению p0.
 кип от внешнего давления" loading="lazy" />
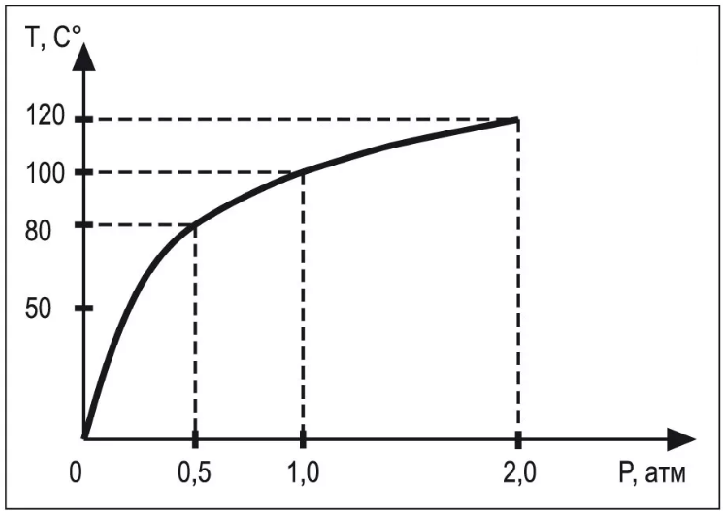
Рис. 4. Зависимость температуры кипения tкип от внешнего давления
кип от внешнего давления" loading="lazy" />
Рис. 4. Зависимость температуры кипения tкип от внешнего давления
Если внешнее давление p0 увеличится, то и давление pнп, необходимое для начала процесса кипения, должно увеличиться. Давление pнп станет больше только в том случае, если увеличится температура жидкости. Таким образом, при повышении внешнего давления увеличится значение температуры кипения.
На рисунке 4 представлен график изменения температуры кипения воды в зависимости от атмосферного давления.
Напомним, что атмосферное давление зависит от высоты над уровнем моря: при подъёме в горы атмосферное давление падает; если же оказаться ниже уровня моря, например, на дне карьера или в глубокой пещере, — атмосферное давление возрастёт.
Температура кипения зависит от внешнего давления: чем больше величина внешнего давления, тем выше температура кипения.
Температура кипения зависит не только от внешнего давления: очевидно, что при одинаковом атмосферном давлении у каждого конкретного вещества будет своя температура кипения. Это объясняется тем, что давление насыщенного пара у разных веществ становится равным внешнему давлению при разных температурах.
В таблице 2 представлены значения температур кипения различных веществ при нормальном атмосферном давлении.
Таблица 2. Температура кипения некоторых веществ при нормальном атмосферном давлении
|
Вещество
|
tкип, °C
|
Вещество
|
tкип, °C
|
|
водород
|
−253
|
медь
|
2 540
|
|
кислород
|
−183
|
свинец
|
1 740
|
|
молоко
|
100
|
железо
|
2 750
|
|
спирт
|
78
|
вольфрам
|
5 680
|
|
эфир
|
35
|
олово
|
2 600
|
|
ртуть
|
357
|
алюминий
|
2 400
|
|
вода
|
100
|
золото
|
2 660
|
Примеры решения задач
Пример 1
Требуется превратить в пар 2 кг воды, взятые при температуре 30 °С. Какое количество теплоты потребуется для этого?
Решение
1. Известно, что вода при нормальном атмосферном давлении кипит при температуре tкип = 100 °С. Следовательно, для превращения воды в пар её необходимо сначала нагреть до 100 °С, затратив на это количество теплоты Q1:
.
2. Количество теплоты Q2, необходимое для превращения жидкости в пар, рассчитывается по формуле:
.
3. Для превращения в пар 2 кг воды, взятой при температуре 30 °С, понадобится количество теплоты, равное:
.
Ответ: .
Пример 2
Определить, какое количество пара, взятого при температуре 100 °С, необходимо использовать, чтобы нагреть 20 л воды от 10 до 40 °С?
Решение
1. При контакте горячего пара с холодной водой начнётся конденсация пара. Как известно, в процессе конденсации выделяется тепло — именно оно используется для нагревания холодной воды. Если пар выделит количество теплоты Q1, а вода получит количество теплоты Q2, то при отсутствии потерь в окружающую среду Q1 = Q2.
2. Количество теплоты, которое выделит пар в процессе конденсации:
.
3. Количество теплоты, которое получит вода, расходуется на её дальнейшее нагревание:
.
4. Массу воды можно найти как произведение её плотности на объём:
.
5. Приравняем формулы и выразим искомую массу пара:
.
Ответ: .
Итоги
- Количество теплоты, необходимое для превращения 1 кг жидкости в пар при постоянной температуре и давлении, называется удельной теплотой парообразования L.
- Количество теплоты, необходимое для обращения жидкости в пар или выделяемое при конденсации, определяется как произведение массы вещества на его удельную теплоту парообразования: .
- Кипение — это процесс интенсивного парообразования, который происходит по всему объёму жидкости при её нагревании. Температура кипения зависит от внешнего давления: чем больше величина внешнего давления, тем выше температура кипения.
Упражнение 1
1. Сколько тепла необходимо затратить для превращении в пар а) 1 кг спирта; б) 600 г ртути; в) 0,8 т воды?
2. Какая энергия выделится при конденсации 300 г спирта?
3. Сколько стоградусного пара требуется для нагревания железной плиты массой 1 т на 50 °С?
Контрольные вопросы
1. Чем отличаются процессы кипения и испарения?
2. Как изменится температура кипения при увеличении атмосферного давления?
3. Как найти количество теплоты, выделяемое при конденсации?
Упражнение 1
1. а) 0,9 МДж; б) 180 кДж; в) 1 840 МДж
2. 270 кДж
3. 9,8 кг
- Удельная теплота парообразования
- Кипение. Температура кипения
- Примеры решения задач
- знать различия между кипением и испарением; определение термина «кипение»; что называют удельной теплотой парообразования; формулу для расчёта количества теплоты, необходимого для превращения жидкости в пар
- уметь объяснять процессы, происходящие внутри жидкости в процессе кипения; находить количество теплоты, необходимое для превращения жидкости в пар; объяснять взаимосвязь между температурой кипения и внешним давлением
- Как зависит давление насыщенного пара от температуры?
- При какой температуре происходит испарение жидкости?
- Может ли вода кипеть при температуре, отличной от 100 °С?
Удельная теплота парообразования
Вам уже известно, что при испарении внутренняя энергия вещества уменьшается, поэтому вещество охлаждается. Однако, если в процессе испарения сообщать жидкости дополнительное тепло, можно поддерживать её температуру неизменной.
Очевидно, что разные жидкости теряют разное количество теплоты при испарении, что связано с различиями во внутреннем строении, поэтому необходимое количество теплоты зависит от рода жидкости.
Удельная теплота парообразования L — это физическая величина, равная количеству теплоты, необходимому для превращения 1 кг жидкости в пар (или пара в жидкость) при постоянной температуре и постоянном внешнем давлении.
В СИ единица измерения удельной теплоты парообразования — джоуль на килограмм (Дж/кг).
В таблице 1 приведены значения удельной теплоты парообразования для некоторых веществ.
Таблица 1. Удельная теплота парообразования некоторых веществ
|
Вещество
|
Удельная теплота парообразования, МДж/кг
|
Вещество
|
Удельная теплота парообразования, МДж/кг
|
|
аммиак
|
1,4
|
эфир
|
0,4
|
|
жидкий воздух
|
0,2
|
ртуть
|
0,3
|
|
спирт
|
0,9
|
вода
|
2,3
|
Из таблицы следует, что для превращения в пар 1 кг эфира необходимо затратить 0,4 МДж. Соответственно, для превращения в пар 2 кг эфира необходимо 0,8 МДж. Ясно, что количество теплоты, необходимое для парообразования жидкости, прямо пропорционально массе этой жидкости. Чем больше масса вещества, тем больше тепловой энергии необходимо затратить — количество теплоты, необходимое для превращения жидкости в пар, прямо пропорционально массе жидкости m:
,
где Q [Дж] — количество теплоты, необходимое для превращения жидкости в пар;
L [Дж/кг] — удельная теплота парообразования;
m [кг] — масса жидкости.
Количество теплоты Q, необходимое для превращения жидкости в пар, находится как произведение удельной теплоты парообразования L на массу этой жидкости m:
.
Конденсация пара всегда сопровождается выделением тепла: термодинамическая система в процессе конденсации нагревается. При этом если для превращения в пар 1 кг спирта требуется 0,9 МДж, то при конденсации того же количества спирта выделится ровно такое количество энергии 0,9 МДж. Поэтому количество теплоты, выделяемое при конденсации жидкости массой m, находится по этой же формуле.
В процессе конденсации выделяется такое же количество теплоты Q, какое было затрачено для превращения данного количества жидкости в пар:
Знак «−» означает, что система выделяет тепло.
Кипение. Температура кипения
Вспомним, что испарение — это переход жидкости в газ, происходящий при любой температуре, при котором молекулы вещества покидают поверхность жидкости или твёрдого тела.
Существует и другой вид перехода из жидкого состояния в газообразное, который происходит внутри объёма жидкости. Данный процесс называется кипением. Кипение, как и конденсация, тоже является видом парообразования, но существуют значительные различия в механизмах протекания данных явлений.
Рассмотрим подробно, что происходит внутри жидкости в процессе кипения.
 Рис. 1. Поднимающиеся пузырьки лопаются, оказавшись в менее нагретых слоях жидкости
Рис. 1. Поднимающиеся пузырьки лопаются, оказавшись в менее нагретых слоях жидкости
При нагревании жидкости в прозрачном сосуде можно наблюдать образование маленьких пузырьков на дне и стенках сосуда — это пузырьки воздуха, присутствующего в воде. В процессе нагревания вода испаряется внутрь этих пузырьков, поэтому в каждом из них помимо воздуха находится насыщенный пар.
Дальнейшее увеличение температуры ведёт к увеличению давления насыщенного пара внутри пузырьков, в результате чего они начинают увеличиваться в объёме. Увеличение объёма приводит к росту силы Архимеда, действующей на пузырьки, а когда выталкивающая сила достигнет определённого значения, пузырёк сможет оторваться от дна и начать всплывать.
 Рис. 2. Когда весь объём воды равномерно прогрет, пузырьки при подъёме увеличиваются в объёме и достигают поверхности — вода кипит
Рис. 2. Когда весь объём воды равномерно прогрет, пузырьки при подъёме увеличиваются в объёме и достигают поверхности — вода кипит
По мере приближения к поверхности жидкости пузырёк проходит через менее нагретые верхние слои воды. Из-за охлаждения насыщенный пар внутри пузырьков конденсируется, пузырьки уменьшаются в объёме и лопаются, не достигнув поверхности (рис. 1).
Когда вода прогреется по всему объёму равномерно, процесс испарения жидкости внутрь пузырьков не будет прекращаться при их подъёме на поверхность. Напротив, всплывая, пузырьки будут увеличиваться в объёме, достигать поверхности воды и лопаться на границе раздела двух сред — вода забурлит — мы наблюдаем процесс кипения (рис. 2). Образование, рост и всплытие пузырьков сопровождаются характерным шумом, по которому можно определить начало и эффективность процесса кипения.
Кипение — это переход жидкости в пар, происходящий с образованием в объёме жидкости пузырьков пара.
Эксперименты показывают, что процесс кипения протекает при определённой температуре — температуре кипения, которая не меняется, пока вся жидкость не перейдёт в парообразное состояние. Отчего же зависит температура кипения?
 Рис. 3. При кипении давление внутри пузырьков больше или равно внешнему давлению
Рис. 3. При кипении давление внутри пузырьков больше или равно внешнему давлению
Как уже было сказано, в процессе кипения пузырьки внутри жидкости растут в объёме, так как давление насыщенного пара внутри пузырьков увеличивается. Понятно, что снаружи на пузырьки действует давление жидкости и атмосферное давление, увеличение объёма возможно только в том случае, если давление насыщенного пара внутри пузырьков будет больше или равно внешнему давлению (рис. 3).
В противном случае, если внешнее давление будет больше давления насыщенного пара внутри пузырьков, пузырьки будут лопаться, не достигнув поверхности.
Температура, при которой жидкость кипит, называют температурой кипения этой жидкости. В процессе кипения температура жидкости не меняется, а всё подводимое тепло уходит на парообразование.
Например, температура кипения воды при нормальном атмосферном давлении равна 100 °С. Пусть сосуд с водой имеет маленькую глубину, в этом случае гидростатическим давлением можно пренебречь. В процессе кипения давление насыщенного пара pнп внутри пузырьков равно давлению p0.
 кип от внешнего давления" loading="lazy" />
Рис. 4. Зависимость температуры кипения tкип от внешнего давления
кип от внешнего давления" loading="lazy" />
Рис. 4. Зависимость температуры кипения tкип от внешнего давления
Если внешнее давление p0 увеличится, то и давление pнп, необходимое для начала процесса кипения, должно увеличиться. Давление pнп станет больше только в том случае, если увеличится температура жидкости. Таким образом, при повышении внешнего давления увеличится значение температуры кипения.
На рисунке 4 представлен график изменения температуры кипения воды в зависимости от атмосферного давления.
Напомним, что атмосферное давление зависит от высоты над уровнем моря: при подъёме в горы атмосферное давление падает; если же оказаться ниже уровня моря, например, на дне карьера или в глубокой пещере, — атмосферное давление возрастёт.
Температура кипения зависит от внешнего давления: чем больше величина внешнего давления, тем выше температура кипения.
Температура кипения зависит не только от внешнего давления: очевидно, что при одинаковом атмосферном давлении у каждого конкретного вещества будет своя температура кипения. Это объясняется тем, что давление насыщенного пара у разных веществ становится равным внешнему давлению при разных температурах.
В таблице 2 представлены значения температур кипения различных веществ при нормальном атмосферном давлении.
Таблица 2. Температура кипения некоторых веществ при нормальном атмосферном давлении
|
Вещество
|
tкип, °C
|
Вещество
|
tкип, °C
|
|
водород
|
−253
|
медь
|
2 540
|
|
кислород
|
−183
|
свинец
|
1 740
|
|
молоко
|
100
|
железо
|
2 750
|
|
спирт
|
78
|
вольфрам
|
5 680
|
|
эфир
|
35
|
олово
|
2 600
|
|
ртуть
|
357
|
алюминий
|
2 400
|
|
вода
|
100
|
золото
|
2 660
|
Примеры решения задач
Пример 1
Требуется превратить в пар 2 кг воды, взятые при температуре 30 °С. Какое количество теплоты потребуется для этого?
Решение
1. Известно, что вода при нормальном атмосферном давлении кипит при температуре tкип = 100 °С. Следовательно, для превращения воды в пар её необходимо сначала нагреть до 100 °С, затратив на это количество теплоты Q1:
.
2. Количество теплоты Q2, необходимое для превращения жидкости в пар, рассчитывается по формуле:
.
3. Для превращения в пар 2 кг воды, взятой при температуре 30 °С, понадобится количество теплоты, равное:
.
Ответ: .
Пример 2
Определить, какое количество пара, взятого при температуре 100 °С, необходимо использовать, чтобы нагреть 20 л воды от 10 до 40 °С?
Решение
1. При контакте горячего пара с холодной водой начнётся конденсация пара. Как известно, в процессе конденсации выделяется тепло — именно оно используется для нагревания холодной воды. Если пар выделит количество теплоты Q1, а вода получит количество теплоты Q2, то при отсутствии потерь в окружающую среду Q1 = Q2.
2. Количество теплоты, которое выделит пар в процессе конденсации:
.
3. Количество теплоты, которое получит вода, расходуется на её дальнейшее нагревание:
.
4. Массу воды можно найти как произведение её плотности на объём:
.
5. Приравняем формулы и выразим искомую массу пара:
.
Ответ: .
Итоги
- Количество теплоты, необходимое для превращения 1 кг жидкости в пар при постоянной температуре и давлении, называется удельной теплотой парообразования L.
- Количество теплоты, необходимое для обращения жидкости в пар или выделяемое при конденсации, определяется как произведение массы вещества на его удельную теплоту парообразования: .
- Кипение — это процесс интенсивного парообразования, который происходит по всему объёму жидкости при её нагревании. Температура кипения зависит от внешнего давления: чем больше величина внешнего давления, тем выше температура кипения.
Упражнение 1
1. Сколько тепла необходимо затратить для превращении в пар а) 1 кг спирта; б) 600 г ртути; в) 0,8 т воды?
2. Какая энергия выделится при конденсации 300 г спирта?
3. Сколько стоградусного пара требуется для нагревания железной плиты массой 1 т на 50 °С?
Контрольные вопросы
1. Чем отличаются процессы кипения и испарения?
2. Как изменится температура кипения при увеличении атмосферного давления?
3. Как найти количество теплоты, выделяемое при конденсации?
Упражнение 1
1. а) 0,9 МДж; б) 180 кДж; в) 1 840 МДж
2. 270 кДж
3. 9,8 кг



