- Первое положение теории строения органических веществ. Структурные формулы
- Второе положение теории строения органических веществ. Изомерия
- Третье положение теории строения органических веществ
- научиться составлять структурные формулы органических веществ
- научиться составлять и определять изомеры
- научиться определять влияние атомов в молекулах веществ друг на друга
- Что такое валентность?
- Чему равны высшие валентности углерода, водорода, кислорода и азота?
- Составьте структурные формулы следующих веществ:
Первое положение теории строения органических веществ.
Структурные формулы
 Рис. 1. Александр Михайлович Бутлеров
Рис. 1. Александр Михайлович Бутлеров
Изучая органические вещества, известный русский учёный Александр Михайлович Бутлеров вывел положения теории строения органических веществ в 1861 году.
Первое положение звучит так: атомы в молекулах соединены друг с другом в определённой последовательности согласно их валентностям.
Последовательность связей между атомами в молекуле отображается структурными формулами: полными или сокращёнными. В качестве примера рассмотрим структурные формулы пропана, имеющего молекулярную формулу .
Полная структурная формула пропана будет иметь следующий вид (рис. 2).
 Рис. 2. Полная структурная формула пропана
Рис. 2. Полная структурная формула пропана
 Рис. 3. Сокращённая структурная формула пропана
Рис. 3. Сокращённая структурная формула пропана
В сокращённой структурной формуле атомы водорода записываются вместе с углеродом, к которому они присоединяются (рис. 3).
Валентность — число химических связей атома в соединении. В органической химии валентность углерода всегда равна IV, водорода и галогенов — I, кислорода — II, азота — III.
Структурные формулы могут быть линейными, разветвлёнными и циклическими (рис. 4).
 Рис. 4. Различные записи структурных формул
Рис. 4. Различные записи структурных формул
Кроме этого в структурных формулах между атомами углерода могут быть кратные связи: двойные и тройные (рис. 5).
 Рис. 5. Кратные связи в структурных формулах
Рис. 5. Кратные связи в структурных формулах
Иногда кратные связи встречаются между атомами углерода и кислорода, углерода и азота.
Пример 1
Составьте полную и сокращённую структурную формулу вещества, молекулярная формула которого
Решение
1. Запишем углеродный скелет, поставив между каждыми соседними углеродами связь:
.
2. Расставим атомы водорода, учитывая валентность углерода, равную четырём, и получим сокращённую структурную формулу:
.
Валентность углерода равна 4, соответственно, у одного атома углерода мы должны занять все четыре связи. Одна «валентность» у крайних углеродов уже занята связью, поэтому мы можем добавить 3 водорода.
У центрального (внутреннего) углерода заняты две «валентности», поэтому к нему ставим всего 2 водорода.
3. Составим полную структурную формулу. Для этого необходимо вновь составить углеродный скелет:
.
Теперь к каждому атому углерода добавим недостающие связи так, чтобы каждый атом был окружён четырьмя чёрточками:

Но связи бывают выражены не только одной линией. Теперь рассмотрим похожий пример, но с использованием кратных связей.
Пример 2
Составьте сокращённые структурные формулы веществ состава и с кратными связями.
Решение
1. Рассмотрим первое вещество с молекулярной формулой:
2. Запишем углеродный скелет, между первым и вторым углеродами поставив двойную связь:
.
3. Расставим атомы водорода, учитывая валентность углерода, равную четырём:
.
4. Рассмотрим второе вещество с молекулярной формулой:
5. Запишем углеродный скелет:
Одной связью мы заняли только одну «валентность» каждого углерода, а доступных атома водорода всего два.
6. Между первым и вторым углеродами поставим тройную связь, так как нам необходимо занять все четыре валентные возможности каждого углерода:
7. Расставим атомы водорода, учитывая валентность углерода, равную четырём:
Упражнение 1
Составьте сокращённые структурные формулы веществ состава с двойной кратной связью с неразветвлённым скелетом, с двойной кратной связью и с разветвлённым скелетом.
Второе положение теории строения органических веществ. Изомерия.
Свойства веществ зависят не только от числа атомов в молекуле, но и их взаимного расположения.
Существуют вещества, имеющие одинаковый качественный и количественный состав, но разное строение.
Такие вещества получили название изомеры, а явление — изомерия.
Изомеры — это вещества, имеющие одинаковый состав, но разное строение.
Выделяют несколько типов изомерии и, соответственно, изомеров.
В первую очередь это структурная изомерия, к которой относятся изомерия углеродного скелета, положения кратных связей, функциональных групп и межклассовая изомерия. Данные изомеры могут быть линейными, циклическими и разветвленными.
Разберём все типы структурной изомерии на примерах.
Пример 3
Составьте изомеры углеродного скелета веществ состава .
Решение
1. Составим линейную сокращённую структурную формулу вещества.
Для этого сначала запишем углеродный скелет, затем расставим атомы водорода, учитывая, что углерод всегда четырёхвалентен.
 Рис. 6. Структурная формула бутана
Рис. 6. Структурная формула бутана
2. Теперь составим структурный изомер.
Для этого уменьшим основную цепь до трёх углеводородов, а четвёртый атом углерода вынесем за пределы основной цепи. Это будет изомер бутана — изобутан или метилпропан.
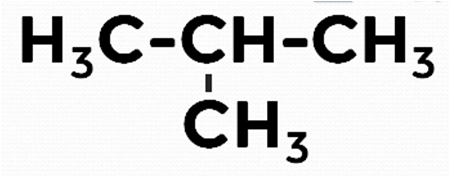 Рис. 7. Структурная формула метилпропана
Рис. 7. Структурная формула метилпропана
3. Изомеры образуются при перестановке углерода к атому, который стоит НЕ первым и НЕ последним.
Рассмотрим две формулы, которые записаны по-разному, но при этом являются не изомерами, а одним и тем же веществом — бутаном:
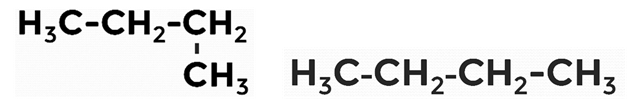 Рис. 8. Структурные формула бутана
Рис. 8. Структурные формула бутана
Если рассматривать вещества с кратными связями, то можно утверждать, что для них также характерна изомерия.
Пример 4
Составьте изомеры положения кратной связи веществ состава .
Решение
Аналогично предыдущему заданию, сначала составляем неразветвленную формулу.
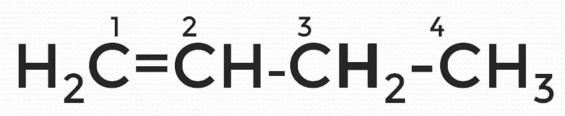 Рис. 9. Структурная формула бутена-1
Рис. 9. Структурная формула бутена-1
Если же мы поставим двойную связь между 2 и 3 атомами углерода, получится структурная формула бутена-2.
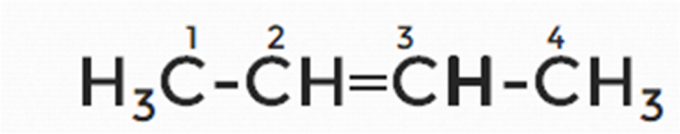 Рис. 10. Структурная формула бутена-2
Рис. 10. Структурная формула бутена-2
Обращаем ваше внимание, что бутена-3 не существует. Это будет всё тот же бутен-1, который мы повернули на 180º.
Упражнение 2
Составьте структурные формулы четырёх возможных изомеров состава .
Третье положение теории строения органических веществ
Атомы или группы атомов в молекулах органических веществ могут оказывать взаимное влияние друг на друга.
Появление в молекулах органических веществ заместителей водорода приводит к смещению электронов (а точнее электронной плотности) от более слабого неметалла к более сильному, что и обуславливает определённые химические свойства веществ.
Проще всего это рассмотреть на примере спиртов и их изомеров простых эфиров.
В молекуле этанола () происходит смещение электронной плотности от водорода и углерода к кислороду, что мы показали стрелками
(рис. 11). Атом водорода будет достаточно подвижным, возникают кислотные свойства. Этанол будет реагировать со щелочными металлами.
 Рис. 11. Смещение электронной плотности в молекуле этанола
Рис. 11. Смещение электронной плотности в молекуле этанола
Диметиловый эфир, являющийся изомером этанола, будет иметь другое строение.
Здесь уже нет подвижных атомов водорода, а следовательно, нет и кислотных свойств, как у спиртов (рис. 12).
 Рис. 12. Смещение электронной плотности в молекуле диэтилового эфира
Рис. 12. Смещение электронной плотности в молекуле диэтилового эфира
Упражнение 3
Объясните, почему уксусная кислота с позиции третьего положения теории химического строения проявляет кислотные свойства.

Контрольные вопросы
- Какие вы знаете положения теории строения органических веществ?
- Что такое изомеры? Какие виды изомерии вы знаете?
- Поясните третье положение теории строения органических веществ.
Ответы
Упражнение 1

Неразветвлённое строение: пентен-1

Неразветвлённое строение: пентен-2

Разветвлённое строение
Упражнение 2

Упражнение 3
Ответ: в уксусной кислоте происходит смещение электронной плотности от атома водорода к кислороду. Атом водорода становится подвижным. Это и обусловливает кислотные свойства данного вещества.
- Первое положение теории строения органических веществ. Структурные формулы
- Второе положение теории строения органических веществ. Изомерия
- Третье положение теории строения органических веществ
- научиться составлять структурные формулы органических веществ
- научиться составлять и определять изомеры
- научиться определять влияние атомов в молекулах веществ друг на друга
- Что такое валентность?
- Чему равны высшие валентности углерода, водорода, кислорода и азота?
- Составьте структурные формулы следующих веществ:
Первое положение теории строения органических веществ.
Структурные формулы
 Рис. 1. Александр Михайлович Бутлеров
Рис. 1. Александр Михайлович Бутлеров
Изучая органические вещества, известный русский учёный Александр Михайлович Бутлеров вывел положения теории строения органических веществ в 1861 году.
Первое положение звучит так: атомы в молекулах соединены друг с другом в определённой последовательности согласно их валентностям.
Последовательность связей между атомами в молекуле отображается структурными формулами: полными или сокращёнными. В качестве примера рассмотрим структурные формулы пропана, имеющего молекулярную формулу .
Полная структурная формула пропана будет иметь следующий вид (рис. 2).
 Рис. 2. Полная структурная формула пропана
Рис. 2. Полная структурная формула пропана
 Рис. 3. Сокращённая структурная формула пропана
Рис. 3. Сокращённая структурная формула пропана
В сокращённой структурной формуле атомы водорода записываются вместе с углеродом, к которому они присоединяются (рис. 3).
Валентность — число химических связей атома в соединении. В органической химии валентность углерода всегда равна IV, водорода и галогенов — I, кислорода — II, азота — III.
Структурные формулы могут быть линейными, разветвлёнными и циклическими (рис. 4).
 Рис. 4. Различные записи структурных формул
Рис. 4. Различные записи структурных формул
Кроме этого в структурных формулах между атомами углерода могут быть кратные связи: двойные и тройные (рис. 5).
 Рис. 5. Кратные связи в структурных формулах
Рис. 5. Кратные связи в структурных формулах
Иногда кратные связи встречаются между атомами углерода и кислорода, углерода и азота.
Пример 1
Составьте полную и сокращённую структурную формулу вещества, молекулярная формула которого
Решение
1. Запишем углеродный скелет, поставив между каждыми соседними углеродами связь:
.
2. Расставим атомы водорода, учитывая валентность углерода, равную четырём, и получим сокращённую структурную формулу:
.
Валентность углерода равна 4, соответственно, у одного атома углерода мы должны занять все четыре связи. Одна «валентность» у крайних углеродов уже занята связью, поэтому мы можем добавить 3 водорода.
У центрального (внутреннего) углерода заняты две «валентности», поэтому к нему ставим всего 2 водорода.
3. Составим полную структурную формулу. Для этого необходимо вновь составить углеродный скелет:
.
Теперь к каждому атому углерода добавим недостающие связи так, чтобы каждый атом был окружён четырьмя чёрточками:

Но связи бывают выражены не только одной линией. Теперь рассмотрим похожий пример, но с использованием кратных связей.
Пример 2
Составьте сокращённые структурные формулы веществ состава и с кратными связями.
Решение
1. Рассмотрим первое вещество с молекулярной формулой:
2. Запишем углеродный скелет, между первым и вторым углеродами поставив двойную связь:
.
3. Расставим атомы водорода, учитывая валентность углерода, равную четырём:
.
4. Рассмотрим второе вещество с молекулярной формулой:
5. Запишем углеродный скелет:
Одной связью мы заняли только одну «валентность» каждого углерода, а доступных атома водорода всего два.
6. Между первым и вторым углеродами поставим тройную связь, так как нам необходимо занять все четыре валентные возможности каждого углерода:
7. Расставим атомы водорода, учитывая валентность углерода, равную четырём:
Упражнение 1
Составьте сокращённые структурные формулы веществ состава с двойной кратной связью с неразветвлённым скелетом, с двойной кратной связью и с разветвлённым скелетом.
Второе положение теории строения органических веществ. Изомерия.
Свойства веществ зависят не только от числа атомов в молекуле, но и их взаимного расположения.
Существуют вещества, имеющие одинаковый качественный и количественный состав, но разное строение.
Такие вещества получили название изомеры, а явление — изомерия.
Изомеры — это вещества, имеющие одинаковый состав, но разное строение.
Выделяют несколько типов изомерии и, соответственно, изомеров.
В первую очередь это структурная изомерия, к которой относятся изомерия углеродного скелета, положения кратных связей, функциональных групп и межклассовая изомерия. Данные изомеры могут быть линейными, циклическими и разветвленными.
Разберём все типы структурной изомерии на примерах.
Пример 3
Составьте изомеры углеродного скелета веществ состава .
Решение
1. Составим линейную сокращённую структурную формулу вещества.
Для этого сначала запишем углеродный скелет, затем расставим атомы водорода, учитывая, что углерод всегда четырёхвалентен.
 Рис. 6. Структурная формула бутана
Рис. 6. Структурная формула бутана
2. Теперь составим структурный изомер.
Для этого уменьшим основную цепь до трёх углеводородов, а четвёртый атом углерода вынесем за пределы основной цепи. Это будет изомер бутана — изобутан или метилпропан.
 Рис. 7. Структурная формула метилпропана
Рис. 7. Структурная формула метилпропана
3. Изомеры образуются при перестановке углерода к атому, который стоит НЕ первым и НЕ последним.
Рассмотрим две формулы, которые записаны по-разному, но при этом являются не изомерами, а одним и тем же веществом — бутаном:
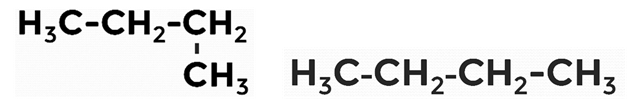 Рис. 8. Структурные формула бутана
Рис. 8. Структурные формула бутана
Если рассматривать вещества с кратными связями, то можно утверждать, что для них также характерна изомерия.
Пример 4
Составьте изомеры положения кратной связи веществ состава .
Решение
Аналогично предыдущему заданию, сначала составляем неразветвленную формулу.
 Рис. 9. Структурная формула бутена-1
Рис. 9. Структурная формула бутена-1
Если же мы поставим двойную связь между 2 и 3 атомами углерода, получится структурная формула бутена-2.
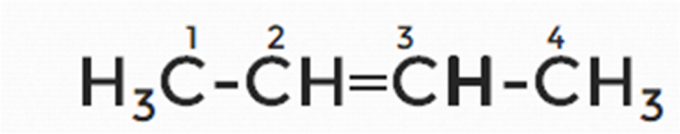 Рис. 10. Структурная формула бутена-2
Рис. 10. Структурная формула бутена-2
Обращаем ваше внимание, что бутена-3 не существует. Это будет всё тот же бутен-1, который мы повернули на 180º.
Упражнение 2
Составьте структурные формулы четырёх возможных изомеров состава .
Третье положение теории строения органических веществ
Атомы или группы атомов в молекулах органических веществ могут оказывать взаимное влияние друг на друга.
Появление в молекулах органических веществ заместителей водорода приводит к смещению электронов (а точнее электронной плотности) от более слабого неметалла к более сильному, что и обуславливает определённые химические свойства веществ.
Проще всего это рассмотреть на примере спиртов и их изомеров простых эфиров.
В молекуле этанола () происходит смещение электронной плотности от водорода и углерода к кислороду, что мы показали стрелками
(рис. 11). Атом водорода будет достаточно подвижным, возникают кислотные свойства. Этанол будет реагировать со щелочными металлами.
 Рис. 11. Смещение электронной плотности в молекуле этанола
Рис. 11. Смещение электронной плотности в молекуле этанола
Диметиловый эфир, являющийся изомером этанола, будет иметь другое строение.
Здесь уже нет подвижных атомов водорода, а следовательно, нет и кислотных свойств, как у спиртов (рис. 12).
 Рис. 12. Смещение электронной плотности в молекуле диэтилового эфира
Рис. 12. Смещение электронной плотности в молекуле диэтилового эфира
Упражнение 3
Объясните, почему уксусная кислота с позиции третьего положения теории химического строения проявляет кислотные свойства.

Контрольные вопросы
- Какие вы знаете положения теории строения органических веществ?
- Что такое изомеры? Какие виды изомерии вы знаете?
- Поясните третье положение теории строения органических веществ.
Ответы
Упражнение 1

Неразветвлённое строение: пентен-1

Неразветвлённое строение: пентен-2

Разветвлённое строение
Упражнение 2

Упражнение 3
Ответ: в уксусной кислоте происходит смещение электронной плотности от атома водорода к кислороду. Атом водорода становится подвижным. Это и обусловливает кислотные свойства данного вещества.

