- Биологические полимеры — белки
- Аминокислоты
- Структуры белковой молекулы
- Свойства белков. Денатурация и ренатурация
- Функции белков
- Ферменты
- Протеомика
- знать особенности структур белка, свойства белков, причины денатурации и ренатурации, определение протеомики
- уметь устанавливать связь между особенностями строения АК и их структурной функцией, составлять схему образования пептидной связи, объяснять, какую роль играют белки в клетках на конкретных примерах, объяснять механизм ферментативных реакций, уметь формулировать задачи протеомики

Это изображение окружающей нас части физической Вселенной в очень мелком масштабе: нанесённая на карту линейка соответствует миллиарду световых лет. Суперкластер Девы (Virgo Supercluster) включает 30 тысяч галактик, лишь одной из которых является Млечный Путь. Но в этом масштабе весь Суперкластер Девы выглядит ничтожно маленькой областью. Вот примерно так же устроено пространство белковых последовательностей, в котором идёт эволюция. А ведь могут быть ещё и другие, небелковые биологические Вселенные.
Биологические полимеры — белки
Белки — азотсодержащие органические макромолекулы, гетерополимеры, мономером является аминокислота (АК).
Белки — протеины (protos — первый, главный) — это главные вещества клетки
(50 % от сухой массы клетки).
Протеины — это белки, построенные только из аминокислот, а протеиды содержат ещё и небелковую часть. Например, переносчик кислорода в эритроцитах крови гемоглобин содержит небелковую часть — гем. Гликопротеиды содержат углеводную часть, липопротеиды — липидную часть, нуклеопротеиды — нуклеиновые кислоты.
Элементарный состав белка: C, H, O, N, S.
В состав белков входят 20 АК.
Аминокислоты
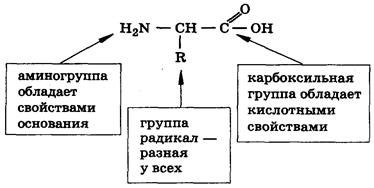 Рис. 1. Общая формула аминокислоты
Рис. 1. Общая формула аминокислоты
Аминокислоты
— амфотерные соединения. Общий принцип строения АК представлен на рисунке 1.
Аминогруппа одной аминокислоты способна вступать в реакцию с карбоксильной группой другой аминокислоты с образованием
дипептида
посредством пептидной связи (рис. 2).
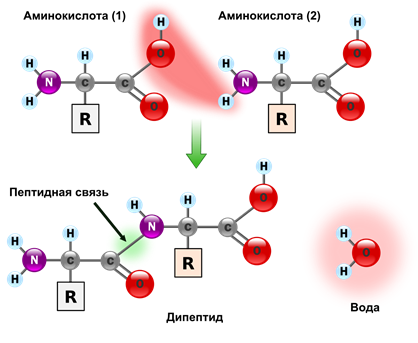 Рис. 2. Образование пептидной связи
Рис. 2. Образование пептидной связи
Образовавшееся из двух и более аминокислотных остатков соединение носит название пептид. К нему могут присоединяться другие аминокислоты, образуя новые пептидные связи, и цепочка, называемая полипептидной , будет расти. На одном конце этой цепочки всегда будет аминогруппа NH2 —, а на другом — карбоксильная группа — СООН.
Полипептидные цепи бывают различной длины, и все они синтезируются в клетке главным образом из аминокислот, получаемых из пищи.
Аминокислоты по способу возникновения в организме можно разделить на две группы.
|
Заменимые
|
Незаменимые
|
|
12 АК, синтезируются
|
8 АК, не могут быть синтезированы должны поступать с пищей
|
Пищевые белки, содержащие все необходимые человеку аминокислоты, называются полноценными . Это главным образом белки животного происхождения. Пищевые белки, не содержащие каких-либо незаменимых аминокислот, называются неполноценными . К ним относятся, например, белки кукурузы, ячменя, пшеницы.
Структуры белковой молекулы (рис. 3)
Специфичная последовательность чередования аминокислот в белке определяется генетически.
|
Структура
|
Основные типы белков
|
|
|
глобулярные — α
|
фибриллярные — β
|
|
|
Первичная
|

|
|
|
Вторичная
|
α-спираль
|
β-спираль
|
|
Удерживается за счёт водородных связей.
|
||
|
Третичная
|
Глобула , образующаяся в результате компактной укладки α-спирали.
|

Фибрилла — β-структуры, уложенные параллельными слоями.
|
|
Удерживается за счёт дисульфидных мостиков (– S – S –).
|
||
|
Четвертичная
|
Несколько третичных глобул и неорганическое вещество.
|
Микрофибриллы , состоящие из соответствующих элементов третичной структуры.
|
|
||
|
Примеры белковых молекул
|
инсулин гемоглобин белки-ферменты
|
миозин актин кератин коллаген фибрин
|
Первичная структура уникальна для каждого белка, и именно от неё зависят свойства молекулы. Замена даже одной аминокислоты чаще всего приводит к необратимым нарушениям структуры и свойств белковой молекулы.
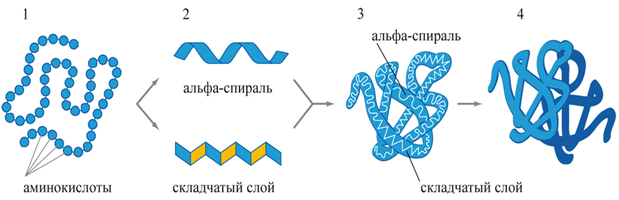 Рис. 3. Структуры белка
Рис. 3. Структуры белка
Свойства белков. Денатурация и ренатурация
Физические и химические свойства белков обусловлены их различным аминокислотным составом. Существуют белки хорошо растворимые в воде и совершенно нерастворимые, химически активные и устойчивые к действию различных агентов, способные укорачиваться и растягиваться и т. д.
Под влиянием факторов — высокой температуры, действия химических веществ, облучения рентгеновскими лучами, механического воздействия, обезвоживании, резком изменении кислотности среды — может произойти разрушение структур белковой молекулы.
Нарушение природной структуры белка называется денатурацией (рис. 4).
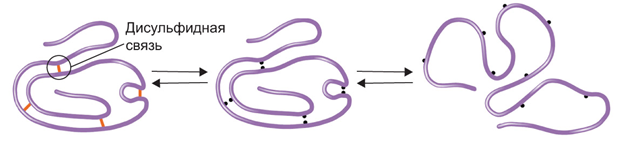 Рис. 4. Денатурация и ренатурация белка
Рис. 4. Денатурация и ренатурация белка
Если воздействие перечисленных факторов было недолгим и несильным, то белок может вернуть свою природную структуру. Обратимая денатурация
( ренатурация ) возможна, если не разрушена первичная структура белка, если же воздействие было долгим или сильным, то происходит нарушение не только третичной и вторичной структур, но и первичной — необратимая денатурация .
Пример денатурации и ренатурации — передача нервного импульса.
Функции белков
|
Функции белков
|
Примеры
|
|
|
Структурная
|
входят в состав клеточных мембран и органелл клеток
|
- липопротеиды, гликопротеиды (структура клеточной мембраны) - коллаген (хрящ, сухожилия) - кератин (ногти, волосы) - оссеин (кости) - эластин (связки) - актин и тубулин (формирование цитоскелета клетки) - фиброин (шёлковые нити, паутина)
|
|
Двигательная
|
сократительные белки участвуют во всех видах движения клеток и организма
|
- актин и миозин (сокращение мышц) - тубулин (движение ресничек и жгутиков, деление клетки)
|
|
Транспортная
|
переносят вещества как внутри клетки, так и в организме в целом
|
- гемоглобин (переносит кислород и углекислый газ в крови) - миоглобин (переносит кислород в мышцах) - липопротеиды, гликопротеиды (транспорт веществ через мембрану)
|
|
Защитная
|
в ответ на внедрение в организм чужеродных белков (антигенов) вырабатываются антитела, обеспечивающие иммунологическую защиту
|
- иммуноглобулины (антитела крови, защита организма) - фибрин и тромбин (свертывание крови) - интерферон (подавляет развитие вирусов) - фибриноген, протромбин (свертывание крови)
|
|
Регуляторная
|
входят в состав многих гормонов, принимают участие в регуляции жизненных процессов
|
- инсулин, глюкагон (гормон поджелудочной железы: регулирует поступление глюкозы в клетки) - тироксин (гормон щитовидной железы: физическое и психическое развитие)
|
|
Рецепторная (сигнальная)
|
приём сигналов из внешней среды в составе мембранных рецепторов обеспечивают ответ клетки на раздражение
|
- гликопротеиды (в составе гликокаликса мембран) - опсин (составная часть светочувствительных пигментов родопсина и йодопсина) - фитохром (светочувствительный белок растений)
|
|
Запасающая
|
резервные источники энергии и веществ
|
- яичный альбумин (запас воды) - ферритин (запас железа в печени, селезёнке) - миоглобин (кислород в мышечных волокнах) - казеин молока (запас питательных веществ) - клейковина (семя растений)
|
|
Энергетическая
|
при расщеплении 1 г белка выделяется 17,6 кДж энергии
|
- казеин молока, клейковина семян пшеницы НО! организм использует белки в качестве источника энергии очень редко, например, при длительном голодании
|
|
Пищевая
|
основной источник аминокислот
|
белки пищи — основной источник аминокислот (особенно незаменимых) для животных и человека казеин (белок молока) — основной источник аминокислот для детёнышей млекопитающих
|
|
Каталитическая
|
биологические катализато- ры — ферменты , ускоряющими либо замедляющими и направляющими биохимические реакции в клетках
|
все ферменты — глобулярные белки каталаза, мальтаза, нуклеаза, липаза, карбоангидраза, сахараза
|
Ферменты
Ферменты (энзимы) — это специфические белки, которые присутствуют во всех живых организмах и играют роль биологических катализаторов.
Химические реакции в живой клетке протекают при умеренной температуре, нормальном давлении и нейтральной среде. В таких условиях реакции синтеза или распада веществ протекали бы очень медленно, если бы не подвергались воздействию ферментов. Ферменты ускоряют реакцию без изменения её общего результата за счёт снижения энергии активации. Это означает, что в их присутствии требуется значительно меньше энергии для придания реакционной способности молекулам, которые вступают в реакцию.
Ферменты отличаются от химических катализаторов:
- высокой степенью специфичности, т. е. фермент катализирует только одну реакцию или действует только на один тип связи;
- скорость ферментативных реакций зависит от многих факторов: природы и концентрации фермента и субстрата, температуры, давления, кислотности среды, наличия ингибиторов и т. д.
Механизм действия фермента (рис. 5)
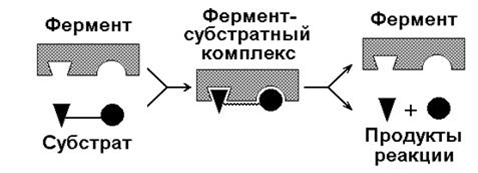 Рис. 5. Этапы ферментативного процесса
Рис. 5. Этапы ферментативного процесса
В молекуле каждого фермента имеется:
-
активный центр
— это участок, в котором происходит катализ за счёт тесного контакта между молекулами фермента и специфического вещества
( субстрата ), форма и химическое строение активного центра таковы, что с ним могут связываться только определённые субстраты в силу их идеального соответствия (комплементарности) друг другу; - кофермент — участок, который определяет конфигурацию активного центра, изменения формы кофермента влечёт за собой изменение активного центра.
Протеомика
Протеом — набор всех белков, содержащихся в клетке.
В последние годы даже выделилась новая биологическая наука, называемая протеомикой . Протеомика изучает структуру белков, их функции, расположение в клетке и их взаимодействие. В настоящее время предполагается, что в человеческом протеоме не менее миллиона белков. Основные задачи протеомики состоят в следующем:
- составление каталогов всех белков, синтезируемых различными типами клеток;
- определение функций выявленных белков;
- изучение взаимодействий различных белков между собой, а также с внеклеточными белками;
- выявление связей между повышением или понижением синтеза какого-либо белка и, например, развитием заболевания.
Связи внутри протеома очень сложны. Например, воздействие на один белок может изменить весь протеом. По изменениям в протеоме можно установить характер таких болезней, как дистрофия, опухолевый рост, инфаркт, гепатит, воспаления, патологии беременности. Многие белки применяются в качестве лекарств, и благодаря успехам протеомики их число значительно увеличилось и будет возрастать в дальнейшем.
Контрольные вопросы
1. Опишите строение аминокислот. Какие бывают аминокислоты?
2. Составьте схему образования пептидной связи.
3. Что определяет первичную структуру белка?
4. Напишите особенности структур белка. Какими связями образована каждая из структур?
5. Что такое денатурация? Назовите причины денатурации и ренатурации.
6. Приведите примеры роли белков в клетках и в организме.
7. Что такое фермент?
8. Какую роль играют активный центр и кoферментный комплекс в процессе ферментативных реакций?
9. Что такое протеомика и каковы её задачи?
Подумайте
1. Какими способами растения защищаются от действия протеаз — ферментов, расщепляющих белки?
2. Известно, что скорость реакции при повышении температуры возрастает. Однако биохимические реакции, протекающие в живом организме, имеют небольшой температурный диапазон, а при температуре выше 45 oС, как правило, прекращаются. Объясните этот факт.
3. Белки способны проявлять свои свойства и выполнять функции, если имеют определённую пространственную конфигурацию. Чем обеспечивается пространственная конфигурация белковой молекулы и как она формируется? Ответ поясните.
4. Какие белки и с какой целью производят для нужд медицины? Ответ поясните.
5. Что такое ренатурация? В каких случаях она возможна? Ответ поясните.

